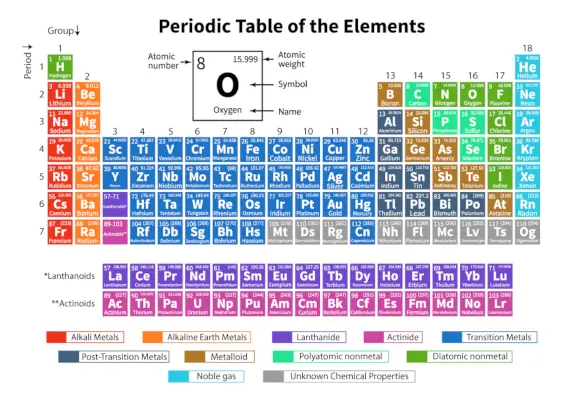
De Periodiske tabell av elementer er et systematisk arrangement av 118 kjente kjemiske elementer. Disse kjemiske elementene er organisert i rekkefølge etter økende atomnummer. De horisontale radene fra venstre til høyre kalles perioder mens de vertikale kolonnene fra topp til bunn kalles grupper i et periodisk system.
Innholdsfortegnelse
- Hva er det periodiske systemet?
- Liste over periodiske tabellelementer
- Viktige termer i det periodiske systemet
- Klassifisering av grunnstoffer i det periodiske systemet
- Mendeleev periodiske system
- Vanlige spørsmål om det periodiske systemet
Hva er det periodiske systemet?
Et periodisk system er en tabellrepresentasjon der alle kjente kjemiske grunnstoffer er ordnet i horisontale rader kalt perioder og vertikale kolonner kalt grupper basert på deres atomnummer og atomstruktur henholdsvis.
Det er et arrangement av alle de kjente elementene og gir derfor informasjon om elementene som deres masse, elektronnummer, elektronkonfigurasjon og deres unike kjemiske egenskaper.
Liste over periodiske tabellelementer
Her er tabellen som representerer 118 elementer i det periodiske systemet. Elementene som er oppført er ordnet i henhold til den økende rekkefølgen av atomnummer og deres respektive atomvekt, symbol, tetthet og elektronegativitet.
| Grunnstoffer i periodisk system med atommasse | |||||
|---|---|---|---|---|---|
| Atomnummer | Kjemisk elementnavn | Symbol | Atommasse (amu) | Tetthet (g/cm 3 ) | Elektronegativitet |
| 1 | Hydrogen | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Helium | Han | 4,0026 | 0,0001785 | – |
| 3 | Litium | At | 6.941 | 0,534 | 0,98 |
| 4 | Beryllium | Være | 9,0122 | 1,85 | 1,57 |
| 5 | Bor | B | 10.811 | 2,34 | 2.04 |
| 6 | Karbon | C | 12.0107 | 2.267 | 2,55 |
| 7 | Nitrogen | N | 14.0067 | 0,0012506 | 3.04 |
| 8 | Oksygen | O | 15,9994 | 0,001429 | 3,44 |
| 9 | Fluor | F | 18.9984 | 0,001696 | 3,98 |
| 10 | Neon | Ja | 20.1797 | 0,0009002 | – |
| elleve | Natrium | Allerede | 22.9897 | 0,968 | 0,93 |
| 12 | Magnesium | Mg | 24.305 | 1.738 | 1.31 |
| 1. 3 | Aluminium | Til | 26,9815 | 2.7 | 1,61 |
| 14 | Silisium | Ja | 28.0855 | 2.329 | 1.9 |
| femten | Fosfor | P | 30,9738 | 1.823 | 2.19 |
| 16 | Svovel | S | 32.065 | 2.07 | 2,58 |
| 17 | Klor | Cl | 35.453 | 0,0032 | 3.16 |
| 18 | Argon | Med | 39.948 | 0,001784 | – |
| 19 | Kalium | K | 39.0983 | 0,89 | 0,82 |
| tjue | Kalsium | At | 40.078 | 1,55 | 1 |
| tjueen | Scandium | Sc | 44,9559 | 2.985 | 1,36 |
| 22 | Titanium | Av | 47.867 | 4.506 | 1,54 |
| 23 | Vanadium | I | 50,9415 | 6.11 | 1,63 |
| 24 | Krom | Cr | 51,9961 | 7.15 | 1,66 |
| 25 | Mangan | Mn | 54.938 | 7.21 | 1,55 |
| 26 | Jern | Tro | 55.845 | 7.874 | 1,83 |
| 27 | Kobolt | Co | 58,9332 | 8.9 | 1,88 |
| 28 | Nikkel | I | 58,6934 | 8.908 | 1,91 |
| 29 | Kobber | Med | 63.546 | 1.9 | 60 |
| 30 | Sink | Zn | 65,39 | 1,65 | 70 |
| 31 | Gallium | Her | 69.723 | 1,81 | 19 |
| 32 | Germanium | Ge | 72,64 | 2.01 | 1.5 |
| 33 | Arsenikk | Som | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Selen | HAN | 78,96 | 2,55 | 0,05 |
| 35 | Brom | Br | 79.904 | 2,96 | 2.4 |
| 36 | Krypton | nok | 83.798 | 3 | 1×10−4 |
| 37 | Rubidium | Rb | 85,4678 | 0,82 | 90 |
| 38 | Strontium | Sr | 87,62 | 0,95 | 370 |
| 39 | Yttrium | OG | 88.906 | 1.22 | 33 |
| 40 | Zirkonium | Zr | 91.224 | 1,33 | 165 |
| 41 | Niob | NB | 92.906 | 1.6 | tjue |
| 42 | Molybden | Mo | 95,94 | 2.16 | 1.2 |
| 43 | Teknetium | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Ruthenium | Ru | 101.07 | 2.2 | 0,001 |
| Fire fem | Rhodium | Rh | 102,91 | 2.28 | 0,001 |
| 46 | Palladium | Pd | 106,42 | 2.2 | 0,015 |
| 47 | Sølv | På | 107,87 | 1,93 | 0,075 |
| 48 | Kadmium | Cd | 112.411 | 1,69 | 0,159 |
| 49 | Indium | I | 114,82 | 1,78 | 0,25 |
| femti | Tro | Sn | 118,71 | 1,96 | 23 |
| 51 | Antimon | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Tellur | De | 127,6 | 2.1 | 0,001 |
| 53 | Jod | Jeg | 126.9045 | 2,66 | 0,45 |
| 54 | Xenon | Bil | 131.293 | 2.6 | 3×10−5 |
| 55 | Cesium | Cs | 132,91 | 0,79 | 3 |
| 56 | Barium | Ikke | 137.327 | 0,89 | 425 |
| 57 | Lantan | De | 138,91 | 1.1 | 39 |
| 58 | Cerium | Dette | 140,12 | 1.12 | 66,5 |
| 59 | Praseodym | Pr | 140,9077 | 1.13 | 9.2 |
| 60 | Neodym | Nd | 144,24 | 1.14 | 41,5 |
| 61 | Promethium | Pm | 145 | 1.13 | 2×10−19 |
| 62 | Samarium | Sm | 150,36 | 1.17 | 7.05 |
| 63 | Europium | Eu | 151.964 | 1.2 | 2 |
| 64 | Gadolinium | Gd | 157,25 | 1.2 | 6.2 |
| 65 | Terbium | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Dysprosium | De | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | Til | 164,9303 | 1.23 | 1.3 |
| 68 | Erbium | Er | 167.259 | 1.24 | 3.5 |
| 69 | Thulium | Tm | 168,9342 | 1,25 | 0,52 |
| 70 | Ytterbium | Yb | 173,04 | 1.1 | 3.2 |
| 71 | Paris | Lu | 174.967 | 1,27 | 0,8 |
| 72 | Hafnium | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantal | Vendt | 180,9479 | 1.5 | 2 |
| 74 | Wolfram | I | 183,84 | 2,36 | 1.3 |
| 75 | Rhenium | Re | 186.207 | 1.9 | 7×10−4 |
| 76 | Osmium | Du | 190,23 | 2.2 | 0,002 |
| 77 | Iridium | Og | 192,22 | 2.2 | 0,001 |
| 78 | Platina | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Gull | På | 196,97 | 2,54 | 0,004 |
| 80 | Merkur | Hg | 200,59 | 2 | 0,085 |
| 81 | Tallium | Tl | 204,3833 | 1,62 | 0,85 |
| 82 | Lede | Pb | 207,2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Vismut | Med en | 208,9804 | 2.02 | 0,009 |
| 84 | Polonium | Etter | 209 | 2 | 2×10−10 |
| 85 | Astatin | På | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10−13 |
| 87 | Francium | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radium | Sol | 226 | 0,9 | 9×10−7 |
| 89 | Aktinium | Og | 227 | 1.1 | 5,5×10−10 |
| 90 | Thorium | Th | 232.0381 | 1.3 | 9.6 |
| 91 | Protactinium | Vi vil | 231,0359 | 1.5 | 1,4×10−6 |
| 92 | Uran | I | 238,0289 | 1,38 | 2.7 |
| 93 | Neptun | f.eks | 237 | 1,36 | ≤ 3×10−12 |
| 94 | Plutonium | kunne | 244 | 1,28 | ≤ 3×10−11 |
| 95 | Americium | Er | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1,28 | – |
| 97 | Berkelium | Bk | 247 | 1.3 | – |
| 98 | California | Jfr | 251 | 1.3 | – |
| 99 | Einsteinium | Er | 252 | 1.3 | – |
| 100 | Fermium | Fm | 257 | 1.3 | – |
| 101 | Mendeleev | Md | 258 | 1.3 | – |
| 102 | Noble | Nei | 259 | 1.3 | – |
| 103 | Lawrencium | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rf | 267 | – | – |
| 105 | Dubnium | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Roentgenium | Rg | 282 | – | – |
| 112 | Kopernikus | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | I | 290 | – | – |
| 115 | Moscovium | Mc | 290 | – | – |
| 116 | Livermorium | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | Og | 294 | – | – |
Viktige termer i det periodiske systemet
| Vilkår typescript datotype | Beskrivelse |
|---|---|
| Atomnummer | Antall protoner som utgjør et grunnstoffs kjerne kalles dets atomnummer (Z). f.eks. Karbon inneholder da 6 protoner, så atomnummeret må bare være 6. |
| Atommasse | Det er definert som gjennomsnittlig masse av atomene til et element. Det måles på grunnlag av den relative naturlige forekomsten av elementets isotoper. Atommasse kalles også Atomvekt (A). Det måles i atommasseenheten (amu). |
| Periode | De horisontale radene fra venstre til høyre i et periodisk system kalles perioder. Det er totalt 7 perioder i det periodiske systemet. Elementene er ordnet horisontalt på grunn av deres likheter i egenskaper, som de samme atomorbitalene og så videre. |
| Gruppe | De vertikale kolonnene fra topp til bunn i et periodisk system kalles grupper. Det er totalt 18 grupper i det periodiske systemet. Elementene er arrangert vertikalt på grunn av deres likheter i egenskaper, da de har samme antall valenselektroner i seg. |
| Symbol på et element | Et symbol er en forestilling som brukes til å representere et kjemisk grunnstoff ved å bruke en bokstav eller en kombinasjon av to til tre bokstaver. f.eks. Det kjemiske symbolet på karbon er C, mens Fe brukes for jern og så videre. |
Klassifisering av grunnstoffer i det periodiske systemet
De 118 elementene er ordnet i 7 perioder og 18 grupper som vist ovenfor. Videre er elementene delt inn i forskjellige blokker.
| Blokkere | Elementer inkludert | Siste elektronunderskall fylt |
|---|---|---|
| s-blokk | Gruppe 1 (alkalimetaller) | s-subshell |
| Gruppe 2 (Alkaliske jordmetaller) | ||
| p-blokk | Gruppe 13 (Boron-familien) | p-subshell |
| Gruppe 14 (karbonfamilie) | ||
| Gruppe 15 (nitrogenfamilie) | ||
| Gruppe 16 (oksygenfamilie) | ||
| Gruppe 17 (Fluorfamilie) | ||
| d-blokk | Gruppe 3 til 12 (overgangselementer) | d-subshell |
| f-blokk | Lanthanider (sjeldne jordelementer) | f-subshell |
| Aktinider |
Mendeleev periodiske system
For å representere likheter og trender i grunnstoffenes oppførsel utviklet Mendeleev det periodiske systemet, som er et arrangement av grunnstoffer i en økende atommasserekkefølge i tabellform.

I følge Mendeleevs periodiske system ble grunnstoffer ordnet i henhold til deres grunnleggende egenskap, atommasse og kjemiske egenskaper. Bare 63 elementer var kjent på tidspunktet for Mendeleevs arbeid. I Mendeleevs periodiske system ble den horisontale raden og de vertikale kolonnene referert til som henholdsvis grupper og perioder.
Imidlertid mislykkes Mendeleevs periodiske system på grunn av mange feil i den. Noen av dem er at den ikke klarte å angi hydrogen og edle gasser i den. Dessuten var den økende rekkefølgen av atommassen til elementene ikke regelmessig gjennom hele tabellen. Selv, oppdagelsen av isotoper bryter Mendeleevs periodiske lov.
Les mer:
- Moderne periodiske system
- Mendeleev periodiske system
- Moderne periodisk lov
- Historien om det periodiske systemet
- Atomstruktur
Vanlige spørsmål om det periodiske systemet
Hva er det periodiske systemet for grunnstoffer?
Det periodiske system av grunnstoffer er et tabellarrangement av kjemiske elementer organisert etter deres atomnummer, elektronkonfigurasjon og tilbakevendende kjemiske egenskaper. Tabellen er delt inn i rader kalt perioder og kolonner kalt grupper eller familier.
Hvem oppdaget det periodiske systemet for grunnstoffer?
Det periodiske system for grunnstoffer ble ikke oppdaget av en enkelt person, men utviklingen er kreditert Dmitri Mendeleev, en russisk kjemiker, som arrangerte grunnstoffer basert på egenskapene deres i 1869.
Hvem laget det moderne periodiske system?
I 1913 introduserte Henry Moseley en oppdatert versjon av det periodiske systemet, ofte referert til som The Modern Periodic Table.
Hvordan er det periodiske systemet ordnet?
Det periodiske system er ordnet i rekkefølge etter økende atomnummer, med elementer gruppert sammen basert på lignende kjemiske egenskaper og ordnet i perioder (rader) og grupper (søyler).
Hva er atomnummer?
Antall protoner som utgjør et grunnstoffs kjerne kalles dets atomnummer (Z). f.eks. Karbon inneholder 6 protoner, dets atomnummer må bare være 6.
Kan to forskjellige grunnstoffer ha samme atomnummer?
Antall nøytroner i et atom fra to forskjellige grunnstoffer kan være likt, men antallet protoner vil aldri være det samme. Hvert grunnstoff har et spesifikt antall protoner, som tilsvarer antall atomer.
Hvordan beregne atommasse?
Atommassen kan beregnes ved å legge til massen av protoner og nøytroner i et grunnstoff.
Hva er en gruppe i det periodiske systemet?
Kolonnen i det periodiske systemet refererer til gruppen av det periodiske systemet. Elementene i samme gruppe har lignende fysiske og kjemiske egenskaper.
