Aufbau-prinsippet er den grunnleggende metoden som forteller oss hvordan elektronene fylles i atombanen. I følge Aufbau-prinsippet følger fyllingen av elektronene i grunntilstanden til et atom et grunnleggende mønster. Dette prinsippet forteller oss at elektronene i atombanen til alle atomer er fylt i stigende rekkefølge av energien deres, og for å finne energien til atombanen følger de n+l-regelen.
Strukturprinsipp
I denne artikkelen vil vi lære om Aufbau-prinsippet, funksjonene til Aufbau-prinsippet, dets unntak og begrensninger i detalj.
Definisjon av strukturprinsipp
Aufbaus prinsipp sier det
Elektroner i forskjellige orbitaler fylles i økende rekkefølge av energien, det vil si at orbitalen med lavest energi fylles først og orbitalen med høyest energi fylles sist.
Ordet 'Aufbau' på tysk betyr 'bygge opp'. Dannelse av orbitaler betyr å fylle orbitaler med elektroner. Den sier at elektronene i atomorbitaler er fylt i stigende rekkefølge av energien til atomorbitalen. Og energien til atombanen beregnes ved å bruke n+l-regelen som sier om elektronet med et høyere tall av n+l-verdien har høyere energi. I regelen diskutert i forrige linje, n forteller Principal Quantum nummer og l forteller Azimuthal Quantum-nummeret.
Hvis to elektroner har samme verdi på n+l så elektronet med en mindre verdi på n har mindre energi og fylles først. Rekkefølgen for å fylle elektronene i en atomorbital er diskutert nedenfor.
Struktur av prinsippdiagram
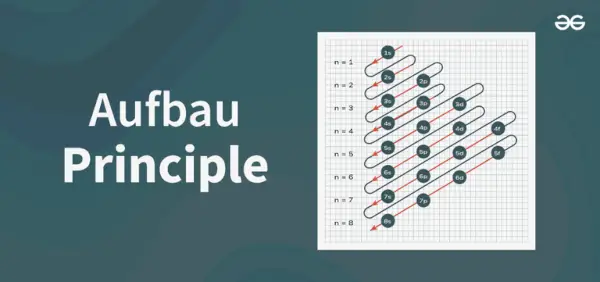
Aufbau-prinsippdiagrammet er diagrammet som viser rekkefølgen for å fylle elektronene i et atom.
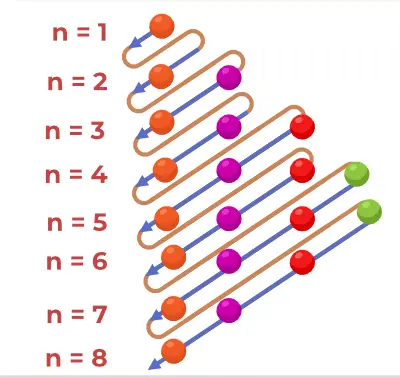
Struktur av prinsippdiagram
Prinsippformelens struktur
Aufbau-prinsippformelen er formelen som forteller i hvilken rekkefølge elektronene er fylt i atombanen. Atomorbitalformelen er
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Prinsippstruktur Klasse 11
Aufbau-prinsippet er et viktig kjemiprinsipp for elevene i klasse 11. Dette prinsippet sier at,
Elektronene i atombanen til et atom er fylt i stigende rekkefølge av energien til atombanen som beregnes ved å bruke (n+l) regelen.
Tegning av strukturdiagrammet
Aufbau Diagram er tegnet ved å bruke trinnene som er lagt til nedenfor,
- Finn antall elektroner som skal fylles i atomene.
- Vi vet at i et atom
- s-orbital kan inneholde maksimalt 2 elektroner.
- p-orbital kan inneholde maksimalt 6 elektroner.
- d-orbital kan inneholde maksimalt 10 elektroner.
- f-orbital kan inneholde maksimalt 14 elektroner.
- Fyll inn de to første elektronene i 1s-orbitalen.
- Følg så n+l-regelen og fyll deretter elektronene tilsvarende.
Fremtredende trekk ved strukturprinsippet
Ulike funksjoner ved Aufbau-prinsippet er,
- Energien til en orbital avhenger av summen av verdiene til hovedkvantetallet (n) og asimutsumtallet (I). Dette kalles (n + l) regel . I henhold til denne regelen,
- I et nøytralt isolert atom, jo lavere verdien av (n + l) for en orbital er, jo lavere er energien. Men hvis to forskjellige typer orbitaler har samme verdi (n + l), så har orbitalene med en lavere verdi på n mindre energi.
| Type orbital | Verdi av n | Verdien av l | Verdi av n+l | Relativ energi |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Laveste energi |
| 2s | 2 | 0 | 2+0 = 2 | Høyere energi enn 1s orbital |
| 2p 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p orbitaler(n=2) har lavere energi enn 3s(n=3) orbitaler. |
| 3 s 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p orbitaler(n=3) har lavere energi enn 4s(n=4) orbitaler. |
| 3d 4 s | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d orbitaler(n=3) har lavere energi enn 4p(n=4) orbitaler. |
Fra beskrivelsen gitt i tabellen følger det at energiene til de forskjellige orbitalene øker med økningen i antallet til hovedkvantetallet.
- Dermed rekkefølgen som elektronene er fylt i atombanen til atom er, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Elektronisk konfigurasjon ved hjelp av Aufbau-prinsippet
De elektronisk konfigurasjon bruk av Aufbau-prinsippet for noen få elementer diskuteres nedenfor:
Elektronkonfigurasjon av svovel
Atomnummer svovel er 16, dvs. den har 16 elektroner
Ved å bruke Aufbau-prinsippet er den elektroniske konfigurasjonen av svovel skrevet som,
[S] = 1s 2 2s 2 2p 6 3s 2 3 s 4
maskinskrift foreach
Elektronkonfigurasjon av nitrogen
Atomnummer av nitrogen er 7, det vil si at det har 7 elektroner
Ved å bruke Aufbau-prinsippet er den elektroniske konfigurasjonen av nitrogenet skrevet som,
[N] = 1s 2 2s 2 2p 3
Unntak fra konstruksjonsprinsippet
Det er noen få unntak fra Aufbau-prinsippet som er krom og kobber. Deres elektroniske konfigurasjon er,
Elektronisk konfigurasjon av Chromium
Den elektroniske konfigurasjonen av Chromium i henhold til Aufbau-prinsippet bør være
- Cr(24): [Ar]3d 4 4s 2
Men konfigurasjonen ovenfor er ikke riktig fordi den faktiske elektroniske konfigurasjonen av Chromium(Cr) er,
- Cr(24): [Ar]3d 5 4s 1
Årsaken til denne elektroniske konfigurasjonen er at halvfylt d-atomorbital er mer stabil enn orbitalen fylt i henhold til Aufbau-prinsippet.
Elektronisk konfigurasjon av kobber
Den elektroniske konfigurasjonen av kobber i henhold til Aufbau-prinsippet bør være,
- Cu(29): [Ar]3d 9 4s 2
Konfigurasjonen ovenfor er ikke korrekt fordi den faktiske elektroniske konfigurasjonen av Copper(Cu) er,
- Cu(29): [Ar]3d 10 4s 1
Årsaken til denne elektroniske konfigurasjonen er at fullfylt d-atomorbital er mer stabil enn orbitalen fylt i henhold til Aufbau-prinsippet.
Les mer
- Kvantetall
- Form av atomorbitaler
- Atomstruktur
Strukturprinsipp – Vanlige spørsmål
Hva er Aufbau-prinsippet i kjemi?
Aufbau-prinsippet i kjemi er det grunnleggende prinsippet som brukes til å fylle elektronene i atomorbitalene til ethvert atom. Denne teoremet forteller oss i hvilken rekkefølge elektronene er fylt i atombanen.
Hvem ga Aufbau-prinsippet?
Aufbau-prinsippet ble gitt av den berømte danske fysikeren Niels Bohr i 1920.
Hva er Paulis eksklusjonsprinsipp?
Paulis eksklusjonsprinsipp sier at i et atom har ingen to elektroner alle fire kvantenummer t han samme. I det minste er ett av kvantetallet forskjellig for alle elektronene i atomet.
Hva er n+l-regelen?
n+l-regelen er regelen som angir at energien til en orbital avhenger av summen av hovedkvantetallet(n) og det azimutale kvantetallet(l). denne regelen kalles (n+l)-regelen.
Hva er unntakene fra Aufbau-prinsippet?
Unntaket fra Aufbau-prinsippet er,
- Elektronisk konfigurasjon av Chromium Cr[24]
- Elektronisk konfigurasjon av kobber Cu[29]
