Atomiske orbitaler , som er matematiske funksjoner, beskriver bølgeoppførselen til elektroner (eller elektronpar) i et atom. Atomorbitaler har forskjellige former i henhold til deres type. De forskjellige formene på atomorbitaler beskriver at det enten er størst eller null sannsynlighet for å finne et elektron rundt kjernen i noen retninger. Det er fire typer orbitaler, hver med en annen form og representert med bokstavene s, p, d og f. s- og p-orbitalene er tatt i betraktning fordi de er de mest tallrike i kjemisk og biologisk kjemi. An s-orbital har en sfærisk kjerne i sentrum, en p-orbital er hantelformet, og fire av de fem d orbitaler er kløverbladformet. Den femte d-orbitalen er utformet som en lang manual med en smultring i midten. Orbitalene til et atom er organisert i lag eller elektronskall.
Hva er atomorbitaler?
Atomorbitaler er det tredimensjonale rommet nær kjernen til et atom hvor muligheten for å oppdage et elektron er størst.
Et atom kan ifølge kvanteatommodellen ha et uendelig antall orbitaler. Disse orbitalene kan klassifiseres basert på størrelse, form eller orientering. En smalere orbital betyr at det er større sannsynlighet for å fange et elektron nær kjernen. Orbitalbølgefunksjonen er ofte kjent som en matematisk funksjon som brukes til å uttrykke koordinatene til et elektron. Sannsynligheten for å lokalisere et elektron er representert ved kvadratet av orbitalbølgefunksjonen. Denne bølgefunksjonen hjelper også med å lage grenseoverflatediagrammer.
Orbital bølgefunksjon
De kvante atommodell spår at et atom kan ha et stort utvalg av orbitaler. Disse orbitalene kan grupperes etter størrelse, geometri eller helning. En redusert orbitalstørrelse øker sannsynligheten for å få et elektron nær kjernen. Den matematiske funksjonen som brukes til å representere et elektrons koordinater kalles orbitalbølgefunksjon . Sannsynligheten for å oppdage et elektron er representert ved kvadratet av orbitalbølgefunksjonen.
Vi kan også bruke denne bølgefunksjonen til å lage grenseoverflatediagrammer. Vi kan bedre forstå formen til orbitaler ved å bruke grenseoverflatediagrammer av den konstante sannsynlighetstettheten for forskjellige orbitaler.
python generere uuid
Former av atomorbitaler
Formene til atomorbitalene varierer. Det vil si at sannsynlighetsfordelingene til elektronene de beskriver rundt kjernen er forskjellige. Det faktum at elektronene i forskjellige orbitaler sannsynligvis er lokalisert i forskjellige områder rundt foreldrekjernen og dermed opplever sistnevntes tiltrekning med varierte styrker, er en av grunnene til at orbitaler varierer i energi. Det er forbløffende at alle orbitaler i et gitt skall av hydrogenatomet har samme energi mens de har varierte former. Dette skyldes eliminering av ulike energirelaterte bidrag.
Men så snart det er et andre elektron, forsvinner degenerasjonen.
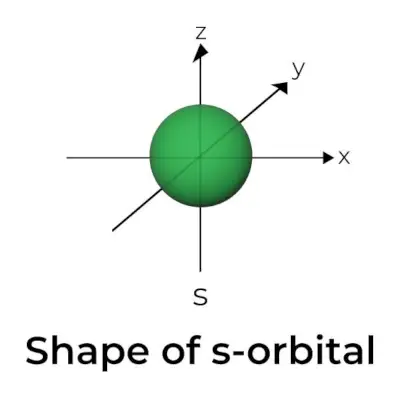
Form på s-orbital
- Det s orbitale grenseoverflatediagrammet ligner en kule med kjernen i sentrum, som kan vises i to dimensjoner som en sirkel.
- s-orbitaler er sfærisk symmetriske, noe som betyr at sannsynligheten for å finne et elektron i en gitt avstand er den samme i alle retninger.
- Størrelsen på s orbital er likeledes vist å øke når verdien av det primære kvantetallet (n) øker; dermed 4s> 3s> 2s> 1s.
- Nodalpunktet er et sted hvor det ikke er sjanse for å lokalisere elektronet. Noder er klassifisert i to typer: radielle noder og vinkelnoder. Avstanden fra kjernen beregnes av de radielle nodene, mens orienteringen bestemmes av vinkelnodene.
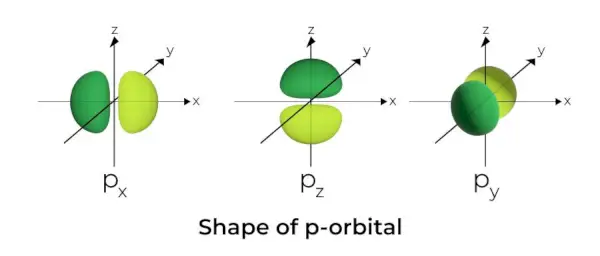
Form på p-Orbital
- P-orbitalene er formet som manualer.
- Den p orbitale noden er lokalisert i kjernens sentrum.
- På grunn av tilstedeværelsen av tre orbitaler, kan p-orbitalen oppta maksimalt seks elektroner.
- Hver p-orbital består av to deler kjent som lober som er plassert på hver side av planet som går på tvers av kjernen.
- Hver p-orbital har deler kjent som lober på hver side av planet som går på tvers av kjernen. I planet der de to lappene krysser hverandre, er sannsynligheten for å finne et elektron null.
- De tre orbitalene er kjent som degenererte orbitaler fordi de har samme størrelse, form og energi.
- Den eneste forskjellen mellom orbitalene er orienteringen til lappene. Fordi lappene er orientert langs x-, y- eller z-aksen, får de navnene 2px, 2py, og 2pz. Formelen n –2 brukes til å beregne antall noder.
- På samme måte som s-orbitaler, øker størrelsen og energien til p-orbitaler når det primære kvantetallet øker (4p> 3p> 2p).
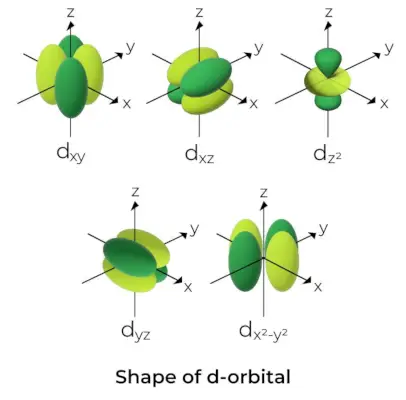
Form av d-Orbital
- For d orbitaler er det magnetiske orbitale kvantetallet gitt som (-2,-1,0, 1,2). Som et resultat kan vi hevde at det er fem d-orbitaler.
- Disse orbitalene er merket med symbolene dxy, dyz, dxz, dx2-og2, og dMed2.
- Formene til de fire første d-orbitalene ligner hverandre, noe som er forskjellig fra dMed2orbital, men energien til alle fem d orbitalene er den samme.
Form av f-Orbital
- Formen til f orbital er spredt. Fordi verdien av l=3 for f orbital, er den minimale verdien av det primære kvantetallet n 4.
- De ekvivalente ml-verdiene for f orbital er (-3,–2, –1, 0, +1, +2, +3).
- Som et resultat er det syv f orbitaler for l = 3.

10 av 50,00
Degenererte orbitaler
Degenererte orbitaler er de med samme energi. Disse orbitalene er forskjellige (de kan være orientert annerledes i rommet rundt atomkjernen ), men de har den samme energien. I nærvær av et eksternt felt er degenerasjonen av p-orbital upåvirket; imidlertid kan degenerasjonen av f- og d-orbitalene brytes ved å påføre systemet et eksternt felt (enten elektrisk eller magnetisk felt).
Få orbitaler vil ha høyere energi, mens andre vil ha lavere energi. Degenerasjon vil ikke lenger eksistere i systemet. For eksempel består d orbitaler av fem degenererte orbitaler som alle har samme energi.
Les mer:
- Molekylær orbitalteori
- Fylling av orbital i et atom
- Hybridisering
Vanlige spørsmål om former for atomorbitaler
Spørsmål 1: Hvordan fungerer orbitaler?
Svar:
En atomorbital er et matematisk uttrykk som uttrykker den bølgelignende oppførselen til ett elektron eller et elektronpar i et atom i atomteori og kvantemekanikk. Hver orbital vil ta opp maksimalt to elektroner, hver med sin egen mengde spinn.
Spørsmål 2: Hva er Nodal Plane?
polymorfisme java
Svar:
Planet der sannsynligheten for å finne et elektron er ubetydelig eller null kalles nodalplanet.
Spørsmål 3: Hvor mange orbitaler er det?
Svar:
Fordi s-undernivået bare har en orbital, kan bare to elektroner være tilstede. Fordi p-undernivået omfatter tre orbitaler, kan maksimalt seks elektroner være tilstede. Fordi d-undernivået omfatter 5 orbitaler, kan maksimalt 10 elektroner være tilstede. Og hvert av de fire undernivåene har syv orbitaler som kan inneholde maksimalt 14 elektroner.
Spørsmål 4: Hvilke orbitaler har høyest energi?
få forbindelse
Svar:
deterministiske endelige automater
Orbital 1s har mest energi. Et elektrons energi er mengden energi som kreves for å få det ut av atomets elektriske boble.
Spørsmål 5: Hva er forskjellen mellom et skall og en orbital?
Svar:
I et atom er et skall en samling av underskall av samme kvantetallteori, n. Orbitaler har hver to elektroner, og elektroner i samme orbital har samme definisjon av størrelse, vinkelmomentstørrelse og magnetisk kvantenummer.
Spørsmål 6: Hva er sigma- og pi-bindingen?
Svar:
Atomorbital overlapping skaper sigma- og pi-bindinger. Sigma-bindinger skapes av overlappende atomorbitallapper, mens Pi-bindinger genereres når en atomorbitallapp overlapper en annen.
