Base er en kjemisk forbindelse som består av OH–ioner og aksepterer protoner. Base i kjemi er de forbindelsene som blir rød lakmusblå og når de reageres med syre nøytraliserer de reaksjonen for å gi salt og vann. Basens pH-verdi er større enn 7. Baser er bitre på smak og glatte i berøring. Basene som er løselige i vann kalles alkalier. Eksempler på baser er metalloksider, metallhydroksider osv. Såpe er et eksempel på en base som vi bruker i dagliglivet. I denne artikkelen vil vi lære om definisjonen, egenskapene og kjemiske reaksjonene til baser i detalj.

Grunndefinisjon
Base er definert som den kjemiske forbindelsen hvis pH-verdi er større enn 7, aksepterer et proton, nøytraliserer syre og gjør rød lakmus til blå. De frigjør generelt OH–ion på dissosiasjon. Eksempler inkluderer NaOH, NaHCO3,osv. Følgende er noen generelle funksjoner som vises av basen:
- De har en bitter smak
- De er glatte i kontakten
- De blir rød lakmusblå
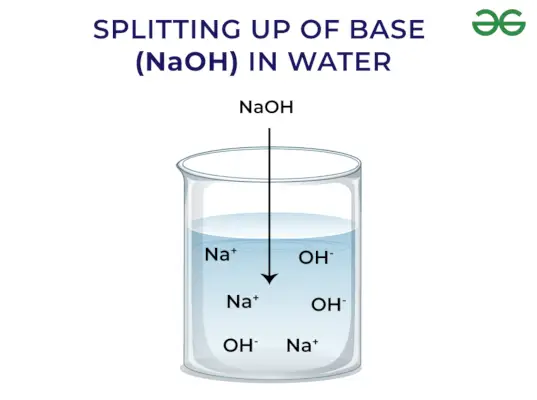
- De frigjør OH–ion når det er oppløst i vann
- De leder elektrisitet i løsningsform
Baser er en av de viktigste kjemiske forbindelsene som brukes i hverdagen. Baser brukes som et syrenøytraliserende middel for å kontrollere surheten og i tannkrem for å nøytralisere den bakterielle virkningen som produserer syre i munnen vår og forhindrer nedbrytning av emalje og hulrom. De brukes også som bakepulver, natron og vaskepulver.
Lewis base
Lewis-baser er forbindelsene som har elektronpar, og de kan donere det til forbindelsene som mangler elektronpar. Lewis-baser er nukleofile i naturen, det vil si at de er kjerneelskende, noe som betyr at de vil angripe et positivt ladet senter med elektronparene sine. Eksempler på Lewis-base inkluderer ammoniakk fordi i ammoniakk (NH3) senteratomet nitrogen har 5 elektroner, hvorav 3 brukes til å lage bindinger med 3 hydrogenatomer og ett elektronpar forblir igjen med N-atomet og dermed lage NH3en Lewis-base.
Arrhenius base
I følge Arrhenius’ konsept er baser forbindelser som frigjør hydroksidioner når de oppløses i vann og øker konsentrasjonen av hydroksylioner i den vandige løsningen. For eksempel, når KOH er oppløst i vann vil det gi OH–ion og dermed øke konsentrasjonen av OH–i vannet.
Bronsted Base
Bronsted Concept of Base er en avansert versjon av Arrhenius’ Concept som sier at baser er forbindelser som aksepterer H+ion eller proton for å danne deres konjugerte syre. For eksempel Cl–er en base som aksepterer H+å danne HCl som dens konjugerte syre.
Typer baser
Baser kan klassifiseres på grunnlag av surhet, konsentrasjon og ioniseringsevne. Klassifiseringen er nevnt nedenfor
Typer baser basert på surhet
Surhet av en base refererer til antall utskiftbare hydroksylgrupper som er tilstede i ett molekyl av basen. Basert på surhet er baser klassifisert i tre kategorier:
- Monosyre base
- Disyrebase
- Triacidisk base
Monosyre: Mono-sure baser er de som inneholder bare ett utskiftbart hydroksylion og samhandler med bare ett hydrogenion. Monosyrebaser inkluderer NaOH, KOH og andre.
Disyre: Disyrebase er en base med to utskiftbare hydroksylioner som interagerer med to hydrogenioner. Ca(OH)2, Mg(OH)2, og andre di-sure baser er eksempler.
Triacidic: Triacidic base er en type base som består av tre utskiftbare hydroksylioner og tre hydrogenioner. Trisyrebaser inkluderer Al(OH)3, Fe(OH)3, og andre.
Typer baser basert på deres konsentrasjon i vandig løsning
Konsentrasjon refererer til mengden av basen tilstede i en vandig løsning. Basert på deres konsentrasjon i vandig løsning, er baser delt inn i to kategorier:
- Konsentrert base
- Fortynnet base
Konsentrert base: Konsentrerte baser er de hvor mengden base er stor sammenlignet med løsningsmidlet. Konsentrert NaOH-løsning, for eksempel.
Fortynnet base: Disse typer baser har en lavere konsentrasjon av base i deres vandige løsning. Fortynning er prosessen med å redusere prosentandelen av et oppløst stoff ved å tilsette mer mengde løsemiddel. For eksempel, fortynn NaOH, fortynn KOH, og så videre.
Typer baser basert på ioniseringsgrad
Ioniseringsgrad refererer til evnen til en kjemisk forbindelse til å frigjøre sin bestanddel når den er oppløst i vann. Når det gjelder Base, refererer graden av ionisering til basens evne til å frigjøre OH–ioner når de er oppløst i vann. Basert på graden av ionisering, er baser klassifisert i to typer:
- Sterk base
- Svak base
Sterk base: Sterke baser er de baser som dissosieres fullstendig og frigjør OH-ion når de er oppløst i vann. Noen eksempler på sterke baser inkluderer NaOH, KOH, etc.
Svak base: Basene som ikke gjennomgår fullstendig dissosiasjon og frigjør bare en brøkdel av OH-ion kalles svak base. Eksempler på svake baser inkluderer Al(OH)3,Cu(OH)2,etc.
Lære mer, Sterke og svake baser
Egenskaper til baser
Ettersom vi vet at baser er kjemiske forbindelser som har OH-ion, blir rød lakmusblå osv. I denne delen vil vi lære om de fysiske og kjemiske egenskapene til baser sammen med litt kort kunnskap om deres generelle egenskaper.
Generelle egenskaper for basen
De generelle egenskapene til baser er nevnt nedenfor:
- Et hydroksidion (OH–) slippes ut i vannet av baser. Jo sterkere basen blir ettersom flere ioner frigjøres.
- Baser reagerer med syre for å danne salt Syrer reagerer med baser. Denne reaksjonen av en base med syre kalles en nøytraliseringsreaksjon.
- Baser blir rød lakmus til blå.
- Et proteins struktur kan endres av baser. Baser har denne kvaliteten, noe som gjør at de føles glatte. Såpe er en base som blir utrolig glatt på huden når den er våt. På grunn av deres evne til å modifisere strukturen til proteiner, er noen kraftige baser ekstremt farlige.
Fysiske egenskaper til baser
Baser smaker bittert: Baser er bitre på smak. På grunn av bitterheten har vi bare noen få alkaliske matvarer. Det er bare noen få alkaliske matvarer. Baser må smakes med mer forsiktighet sammenlignet med syrer.
Basene er glatte i berøring: Ved berøring føles basene glatte. For eksempel såpe.
Baser frigjør OH – Ion: Når baser er oppløst i vann frigjør de hydroksylion (OH–). Avhengig av evnen til å frigjøre hydroksylioner er de klassifisert som sterke og svake.
Baser nøytraliserer syrer: Når baser reagerer med syrer, nøytraliserer de hverandre og produserer salt og vann. Denne reaksjonen kalles Nøytraliseringsreaksjon . La oss si at vi har syren HY og basen 'XOH', så vil saltet som dannes være 'XY'. Ligningen for denne reaksjonen kan gis som HY + XOH → HOH + XY.
Baser Denature Protein: Denaturering av protein betyr ødeleggelse av stabiliteten og strukturen til proteinet. Dette gjør bruk av base skadelig for mennesker, da menneskelig hud og hår består av protein, og når sterke alkalier som natrium- eller kaliumhydroksid også kalt lut brukes, skaper de en skadelig innvirkning på menneskelig hud.
Baser blir rød lakmus til blå: Når baser bringes i kontakt med rød lakmus, blir den blå. Det skal imidlertid bemerkes at ingen slik endring kan observeres når vi prøver å reagere tørr base med rødt lakmuspapir. Lakmuspapirtesten er en av de eldste metodene for å teste base. Imidlertid finnes det også andre indikatorer som fenolftalein
Baser leder elektrisitet: Når baser er i løsningsform, har de mobilt OH-ion, og kan derfor lede elektrisitet.
Kjemiske egenskaper til baser
- Reaksjon av base med metaller: Når alkali (base) reagerer med metall, dannes salt og hydrogengass.
Alkali + Metall → Salt + Hydrogen
Eksempler:
- Når natriumhydroksid interagerer med aluminiummetall, dannes natriumaluminat og hydrogengass.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Når natriumhydroksid interagerer med sinkmetall, produserer det hydrogengass og natriumsinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reaksjon av ikke-metalliske oksider med base: Salt og vann dannes når ikke-metalliske oksider reagerer med en base.
Ikke-metallisk oksid + Base → Salt + Vann
Når kalsiumhydroksid, blir en base reagert med karbondioksid, deretter produseres kalsiumkarbonat og vann.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reaksjon av alkalier/base med ammoniumsalter: Ammoniakk produseres når alkalier reagerer med ammoniumsalter.
Alkali + Ammoniumsalt → Salt + Vann + Ammoniakk
Når kalsiumhydroksid reagerer med ammoniumklorid, produseres kalsiumkloridvann og ammoniakk.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Eksempler på baser
Baser er generelt metalloksid, metallhydroksid, metallhydrogenkarbonat, metallkarbonater osv. La oss se noen av eksemplene på baser med deres anvendelse i tabellform:
| Baser | applikasjoner |
|---|---|
| Kaliumhydroksyd KOH | Brukes i alkaliske batterier |
| Natriumhydroksid NaOH | Brukes i produksjon av såpe og vaskemiddel |
| Magnesiumhydroksid Mg(OH) 2 | Brukes som syrenøytraliserende midler |
| Natrium bikarbonat NaHCO 3 | Brukes som natron |
| Natriumkarbonat Allerede 2 CO 3 | Brukes som vaskebrus java returkommando |
| Ammoniakk NH 3 | Brukes i produksjon av rengjørings- og farmaprodukter |
| Kalsiumhydroksid Ca(OH) 2 | Brukt i White Washing |
Bruk av baser
Det er forskjellige bruksområder for base, noen av disse er:
- Natriumhydroksid brukes til fremstilling av såpe og papir. Natriumhydroksid (NaOH) brukes også i produksjonen av rayon.
- Blekepulver er laget av Ca(OH)2, vanligvis kjent som lesket kalk eller kalsiumhydroksid.
- Kalsiumhydroksid brukes til å lage tørre blandinger for maling og dekorering.
- Magnesiumhydroksid, populært kjent som melk av magnesia, er et avføringsmiddel som er mye brukt. Det brukes også som et syrenøytraliserende middel siden det reduserer overflødig surhet i menneskets mage.
- I laboratorier er ammoniumhydroksid et kritisk reagens.
- Lesket kalk kan brukes til å nøytralisere eventuell overflødig surhet i jord.
Les mer
- Syre, base og salt
- Styrken til syre
- Ionisering av syre og base
Vanlige spørsmål om baser i kjemi
1. Hva er baser?
- Baseforbindelser har en bitter smak til dem.
- Teksturen på de fleste baser er såpeaktig.
- Når det testes på lakmuspapir, forvandler det rødt lakmuspapir til blått lakmuspapir i de fleste tilfeller.
- I løsning leder baseforbindelsene også elektrisitet.
- Når baseforbindelser løses i vann, frigjøres OH-ioner.
2. Hva er funksjonene til baser?
Hjemme bruker vi baser som rengjøringsmidler og syrenøytraliserende midler. Såper, lut (som brukes i ovnsrens), magnesiamelk og Tums er alle eksempler på populære hjemmelagde baser. Hver av dem har en pH større enn syv, kan konsumere fritt hydrogen og nøytralisere syrer.
3. Hva er det viktigste skillet mellom en syre og en base?
Syrer og baser er to typer etsende kjemikalier. Sure materialer har en pH-verdi mellom 0 og 7, mens baser har en pH-verdi mellom 7 og 14. Syrer er ioniske kjemikalier som brytes ned i vann for å lage hydrogenionet (H+) mens Base dissosieres og gir OH-ion.
4. Hva er de fysiske egenskapene til baser?
- De har en bitter smak.
- Deres vandige løsninger har en såpeaktig kvalitet.
- De endrer fargen på lakmuspapir fra rødt til blått.
- Deres vandige løsninger er elektrisk ledende.
- Med frigjøring av hydrogengass reagerer baser med metaller for å generere salt.
5. Hva vil skje når kalsiumhydroksid reagerer med ammoniumklorid?
Når kalsiumhydroksid reagerer med ammoniumklorid, produseres kalsiumkloridvann og ammoniakk.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Hva vil skje når natriumhydroksid reagerer med sinkmetall?
Når natriumhydroksid interagerer med sinkmetall, produserer det hydrogengass og natriumsinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Hva er Lewis Base?
Lewis Base er forbindelsene som donerer et elektronpar til den elektronmangelfulle forbindelsen. Eksempel inkluderer NH3.
8. Hva er baser laget av?
Baser består vanligvis av OH–ion. Bortsett fra disse metalloksidene er karbonater og hydrogenkarbonater også baser.
9. Hva er alkalier?
Basene som er løselige i vann kalles alkalier. Et eksempel er natriumhydroksid NaOH.
10. Hva er sterk base og svak base?
Basene som dissosieres fullstendig for å gi OH–ioner ved oppløsning i vann kalles Strong Base. Eksempler inkluderer NaOH. Svake baser er de som ikke dissosieres fullstendig for å frigjøre OH–ion kalles en svak base. Eksempler på svake baser inkluderer ammoniumhydroksid.
